En octobre, un premier patient a fait l’objet d’un essai clinique de phase 3 afin d’étudier la sécurité et l’efficacité d'un médicament polyclonal anti-SARS-CoV-2 à base d’immunoglobuline hyperimmune (CoVIg hyperimmune). Le médicament hyperimmun sera utilisé dans l’étude du traitement des patients présentant des complications graves dues à la COVID-19. (Lire le communiqué de presse complet ici).
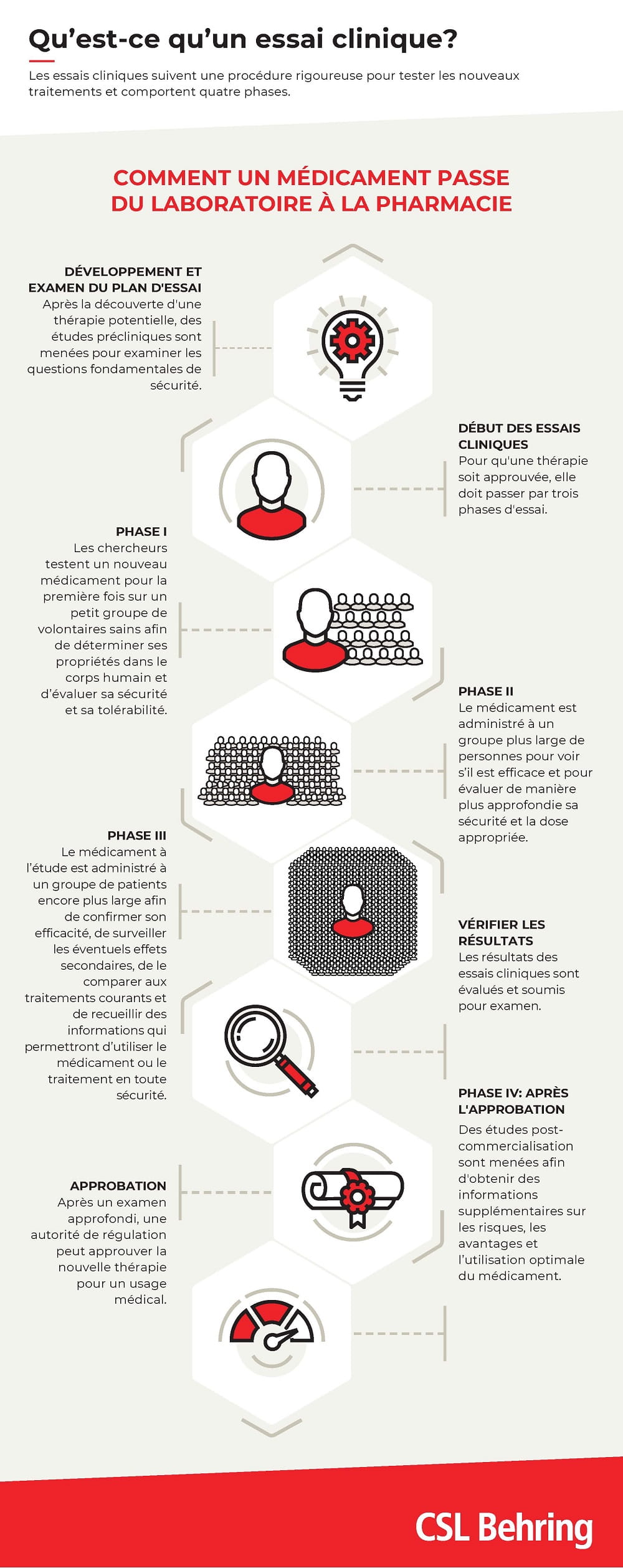
Les essais cliniques suiventune procédure rigoureuse pour tester les nouveaux traitements et comportent quatre phases (voir schéma). Chaque phase d’un essai clinique répond à un objectif spécifique. La phase III est toutefois particulièrement importante. En effet, c’est dans celle-ci que le médicament étudié est administré à une cohorte de personnes plus importante. Le nombre de personnes dépend de différents critères, tels que le type de maladie ou l’effet thérapeutique. En phase III, il est possible que plusieurs milliers de patients soient nécessaires afin de confirmer l’efficacité du médicament, de surveiller les éventuels effets secondaires, de le comparer avec les traitements courants et de recueillir des informations qui permettront d’utiliser le médicament en toute sécurité.
Une procédure accélérée grâce à des procédés de fabrication déjà testés
Normalement, les trois premières phases des essais cliniques d’un nouveau médicament prennent beaucoup de temps et il faut des années pour obtenir l’autorisation de distribution sur le marché. Toutefois, dans le cas du développement de l’immunoglobuline hyperimmune, il est possible de s’appuyer sur des processus de production déjà testés et des essais cliniques déjà réalisés, car celle-ci peut être produite de la même manière qu’un médicament déjà disponible sur le marché et utilisé pour le traitement d’autres maladies immunodéficitaires.
Pour cette raison et grâce à l'approbation spéciale de l’Administration des Denrées Alimentaires et des Médicaments FDA (U.S. Food & Drug Administration) aussi bien qu’au soutien des Instituts Nationaux de la Santé (NIH) des États-Unis, il a été possible de passer les phases cliniques I et II et d’en venir directement à la phase décisive III, ce qui a permis de gagner un temps précieux dans la lutte contre le coronavirus.
En début d’année, un grand groupe d’entreprises leaders du secteur du plasma, dont les membres fondateurs sont CSL Behring et Takeda, a lancé la CoVIg-19 Plasma Alliance dans le but de faire progresser le développement et la distribution d’un médicament hyperimmun dans la lutte mondiale contre la COVID-19. Cet été, des doses cliniques de ce médicament potentiel ont été fabriquées dans les installations de CSL Behring à Berne et ensuite envoyées sur le site de Marbourg, en Allemagne, afin d’y être emballées.
Qu’est-ce qu’un essai clinique?
Les quatre phases de développement d’un nouveau produit sont les mêmes dans le monde entier (voir schéma). Les données qui en résultent sont utilisées par les autorités sanitaires pour décider de l’approbation de nouveaux traitements dans le pays concerné.